4月7日,北京市医保局、市卫生健康委等九部门联合发布《北京市支持创新医药高质量发展若干措施(2025年)》(简称《若干措施2025版》),从创新研发、临床试验、审评审批、生产制造、流通贸易、临床应用等全链条提出新一轮32条措施,持续完善“一条链”服务,进一步推动北京市“万亿”医药健康产业再上新台阶。这是北京市医保局、市卫生健康委等九部门连续第二年共同出台支持创新医药高质量发展的专项政策,2024年4月17日发布的《北京市支持创新医药高质量发展若干措施(2024年)》(简称《若干措施》)实施成效显著。本文对两版政策进行对比,结合北京支持创新医药发展的实际成效,梳理《若干措施2025版》的政策亮点。
一、新增两大重点任务,助力提升产业能级
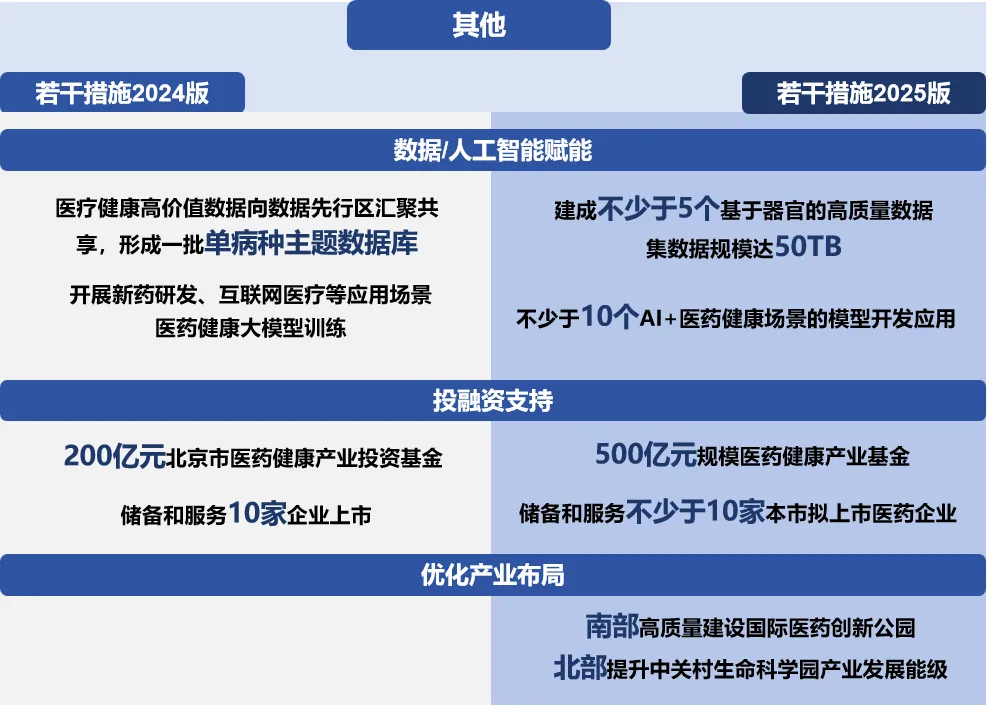
人工智能赋能产业的“底色”更为浓重
《若干措施2025版》从“数据赋能”进阶到了“人工智能(AI)赋能”,一是持续探索破解当前医疗数据“量不足、质不高、用不畅”的问题,在促进医疗数据采集、清洗、标注规范化发展的基础上,明确提出建成不少于5个基于器官的高质量数据集,数据规模达50TB,赋能AI医疗模型训练;二是推动医疗行业大模型从开发阶段进入应用阶段,提出鼓励设立人工智能研发中心开展人工智能赋能新靶点发现、新机制探索等研究,支持AI+病理、辅助诊断、手术规划、制药等不少于10个场景的模型开发应用,多举措推进北京市AI+医药健康从“单一场景验证”走向“全链条应用”。此外,对于监管科学创新也要求探索AI赋能。
2025年2月,国内首个AI儿科医生“上岗”,依托由北京儿童医院与北京百川智能科技有限公司、小儿方健康科技(北京)有限公司联合研发的“福棠·百川”儿科大模型,可担任儿科专家的临床科研助理,帮助医生快速获取最新科研成果和权威指南,辅助医生进行儿科疑难罕见病的诊断和治疗,提升临床决策效率。
突出强化“南北联动”提升发展能级
《若干措施2025版》提出要优化创新医药产业布局。南部高质量建设国际医药创新公园,对标国际一流产业社区,建设全国医药创新人才在华创业第一站,共同打造首都南部医药产业升级新引擎。北部提升中关村生命科学园产业发展能级,加快建设专业园区、综保区、研发验证平台以及服务科学家创业全过程的专业孵化器,共同打造原始创新与未来产业策源地。通过区域协同发展形成互补,实现从研发到转化的全链条创新生态构建,整体提升北京医药产业竞争力。
2024年7月,北京亦庄宣布建设BioPark,总用地面积约5.8平方公里,集总部集聚区、研发转化区、医工融合区、医药智造区等四大功能区于一体。2025年3月,拜耳·亦庄开放创新中心、美敦力数字化医疗创新基地正式启动,辉瑞北京研发中心正式启用。
昌平生命科学园目前已聚集了700多家创新企业,其中上市企业8家、独角兽企业4家、潜在独角兽企业17家、知名科学家创办企业超百家。2024年昌平区医药健康产业全年收入预计首次突破千亿元大关,作为首都北部具有全球领先水平的“生命谷”、锚定世界级高地的生命科学创新走廊正在加速形成。
二、聚焦五大关键环节,全链条升级支持举措
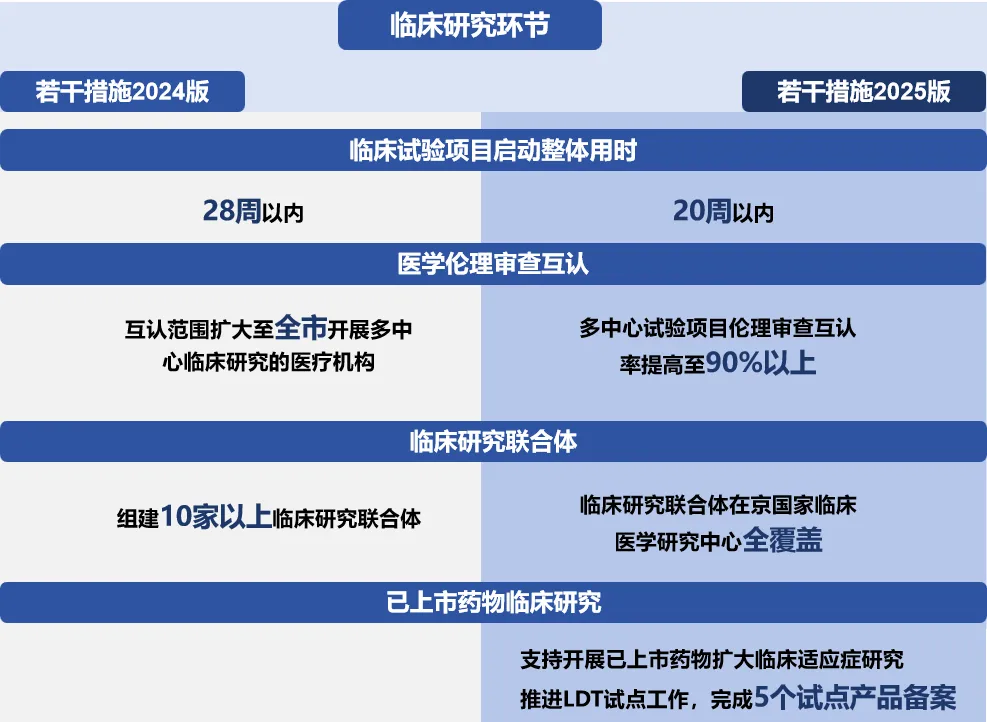
临床试验环节,加速提质增效步伐
在临床试验效率提升方面,项目启动和医学伦理审查效率目标均明显提升,与《若干措施》相比,临床试验启动时间由28周压缩至20周,比上海市在《支持生物医药产业全链条创新发展的若干意见》提出的目标进一步缩短5周;同时,在医学伦理审查结果互认实现全市多中心临床研究医疗机构全覆盖的基础上,进一步落实到多中心试验项目层面,要求互认率目标达到90%以上,进一步和国际领先水平接轨。在促进医产协同创新方面,新增重点专病全自动智能化生物样本库建设任务,协助围绕肿瘤、心脑血管、神经退行性疾病开展重大疾病的机制研究;加快推进医疗机构自行研制使用体外诊断试剂试点工作,并明确提出完成5个试点产品备案。
2024年,通过大力开展研究型病房示范建设,优化临床试验启动流程,建立全流程临床试验效率监测体系等措施,北京市临床试验启动用时(中位数)已缩短至24.9周,同比减少7.7周。
2023年北京和上海陆续出台关于LDT(医疗机构自行研制使用体外诊断试剂)试点的官方文件,北京协和医院等6家医疗机构成为首批试点单位,上海遴选复旦大学附属肿瘤医院等4家医疗机构作为试点单位。2024年7月19日,上海交通大学附属上海儿童医学中心的“五项抗癫痫药物浓度测定试剂盒(液相色谱串联质谱法)”成为国内首个完成备案的自行研制使用体外诊断试剂。
审评审批环节,显著提升服务能效
临床试验审评审批方面,持续深化国家药监局相关试点工作,将优化创新药临床试验审评审批试点扩大到医疗器械,将药品补充申请审评审批试点争取扩大至仿制药申请。药械检验检测能力方面,首次明确提出提效量化目标,推动实现无源医疗器械和诊断试剂平均缩减至60个工作日、有源医疗器械平均缩减至90个工作日,持续保持医疗器械检验能力全国领先地位。针对临床急需药械产品,在全国率先实现即收即检。项目制管理方面,持续扩大服务范围和对象,较2024年新增纳入项目制服务药械品种数量100项,累计达300项。多项举措助力药械产品上市“加速度”,实现2025年新获批创新药械产品数量不少于15个。
优化创新药临床试验审评审批试点工作方面,北京市已发布2批16家药物临床试验试点机构名单,成功推动9个创新药临床试验项目纳入试点,临床试验审评最快用时18个工作日,临床试验启动最快用时3周。
2024年完成约200个创新药械产品纳入项目制管理,推动171个创新药获批临床试验,26个品种纳入国家药监局优先审评与突破性治疗品种,33个医疗器械进入创新特别审查程序。今年以来,北京市已获批8款创新药械(见表1),数量居全国首位。
表1 2025年北京市已获批创新药械品种
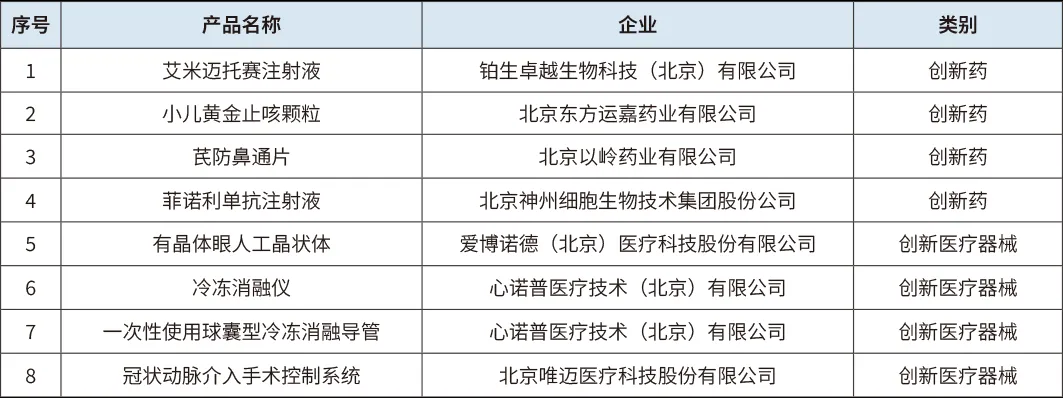
表格信息来源:根据国家药监局公开信息整理
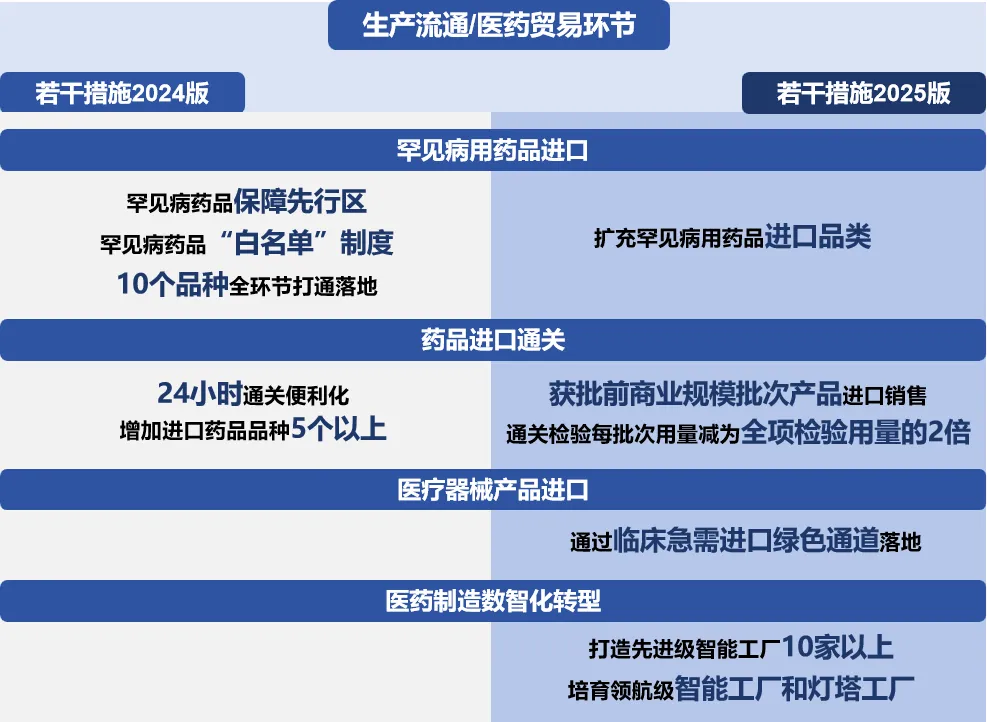
生产流通环节,加大“引进来”力度
《若干措施2025版》明确鼓励创新医药本地化生产,支持企业从国外引进重大药械品种,推动创新药械品种产业化落地和规模化应用,“一企一策”做好服务。提出支持境外药品上市许可持有人跨境分段生产,开展生物制品分段生产试点;支持跨国企业以委托生产方式办理药品生产许可证并在京上市,探索开展医疗器械产品跨境委托生产先行先试。助力境内生产深度融入全球供应链,进一步稳定外资企业预期,吸引跨国医药企业扩大在华投资,引进先进技术和研发经验。
2025年1月,国务院办公厅发布《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》,在全国层面旗帜鲜明地提出支持“开展跨境分段生产”。上海在去年7月发布的《关于支持生物医药产业全链条创新发展的若干意见》中也已提出“探索推动生物药跨境在沪分段生产”。
此前,国内生物制品分段生产(非跨境)试点获批2个。上海率先研究制定质量监管方案,成为全国首个省级层面的分段生产试点,广东省是全国第二个获批生物制品分段生产试点的省份,也是当前试点品种数量最多的地区。
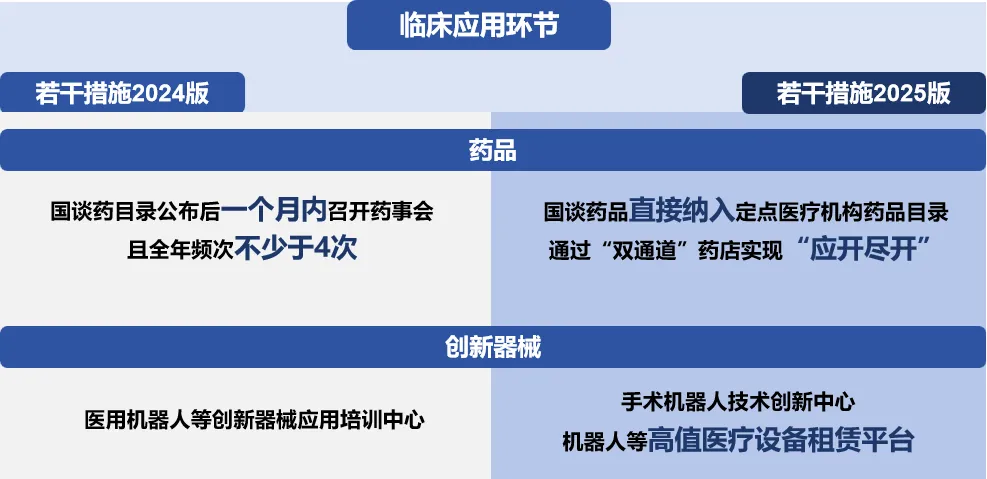
上市应用环节,入院方式再度创新
创新药方面,相较于上海、广东等地增加召开药事会频次,北京率先提出国谈药可直接纳入全市定点医疗机构药品目录,无需召开药事会,医疗机构可通过“双通道”药店实现“应开尽开”。此外,支持医疗机构针对创新价值高但临床数据较少、实际证据不充分的药物开展真实世界研究,验证药物临床价值。创新医疗器械方面,搭建机器人等高值医疗设备租赁平台,运用市场化方式打通创新医疗器械入院“最后一公里”,破解创新医疗器械高成本与推广难的矛盾,加快手术机器人入院应用和创新迭代。
2025年4月,在“服务租赁”模式助推下,天智航天玑2.0骨科手术机器人在北京老年医院完成装机,成为北京市首台以“服务租赁”模式进入医院的骨科手术机器人。中关村发展集团依托中关村科技租赁,与手术机器人生产商开展合作,购买手术机器人及其全套技术服务包,并委托技术服务合作方与医院签订设备服务协议,医院根据骨科机器人的开机使用次数,支付单次固定的服务费。通过这种市场化的方式,医院端降低大额资金支付压力,企业端实现资金回笼和技术升级,有效破解了创新医疗器械进医院难的问题。
投融资环节,基金规模再上新台阶
《若干措施2025版》为进一步加强对创新药械研、产、审、用全链条政策支持,构建500亿元规模医药健康产业基金加强投融资支持,包括新设100亿元规模医药并购基金,发挥市级200亿元、区级100亿元两级生物医药投资基金协同作用,带动100亿元规模社会基金,制定更包容、更体现创业友好型特征的相关制度,投早投小投长期,持续赋能创新药、创新医疗器械高质量发展。
2024年3月,规模200亿元的北京市医药健康产业投资基金正式设立。截至2024年底,基金已围绕早期研发和产业化落地“两头”完成44个项目投决,投决金额和带动社会资本投入近90亿元。2025年北京再新设100亿元规模的医药并购基金,将构建全周期接续支持、市区协同的医药健康产业基金体系。
三、北国咨观点
我国药品医疗器械审批监管制度改革历经十年的稳步探索,获得了阶段性的成效,为医药行业的创新发展筑牢了坚实根基。在此背景下,北京呼应国家改革大势发布新一轮政策,在加速临床试验、提高审评审批效率、促进“人工智能+”应用等方面提出了一系列突破性举措,一方面是积极落实国家要求,确保改革精神精准落地;另一方面,是作为首善之都勇于率先探索监管科技创新,为自主创新营造优渥环境,展现了北京推动创新医药发展的坚定决心和积极作为。全市主管部门建立分段负责、握手接力的服务机制,从早期研发指导,到审批流程优化,再到上市后推广助力,各环节紧密配合、接续做好全流程服务,将更好地释放政策效能、激发企业创新活力,推动北京市创新医药在全国乃至全球引领发展。
附:《若干措施》新旧政策主要变化对比

作者介绍
谢亚楠
产业咨询师
长期专注医药健康、生物制造等生物经济重点领域的产业研究、政策研究和规划咨询。深度参与北京医药健康、合成生物制造等产业发展研究,完成《完善北京市支持创新药械发展的监管和支付机制研究》《北京合成生物发展现状及未来发展路径研究》《京津冀生命健康先进制造业集群发展情况跟踪评估》等多项政策研究与评估咨询,具备丰富的课题研究、项目咨询经验。
叶晓彤
产业咨询师
长期专注研究生物经济领域产业规划、产业政策和项目咨询。深度参与医药健康产业动态监测、创新药械监管等课题研究,深度参与多项项目可研与专项评估,具有丰富的课题研究、项目咨询经验。
编辑:张 华
审核:兰国威

